张瑞艳+何艮+周慧慧
摘要:将植物乳酸菌P-8以灭活的形式添加到大菱鲆幼鱼的两种基础饲料中,旨在研究灭活植物乳酸杆菌(HK-LP)对大菱鲆饲料中豆粕替代鱼粉的影响。试验结束时取血测定血清超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、碱性磷酸酶(ALP)、谷草转氨酶(AST)、谷丙转氨酶(ALT)活力和总蛋白(TP)、胆固醇(TCHO)、甘油三酯(TGK)含量。结果显示,D因素和P因素在AST、ALP、TGK和SOD有显着交互作用(P<0.05)。D因素ALT、TCHO、TP、TGK、MDA和SOD有显着性影响(P<0.05);P因素对SOD、ALP、AST、ALT、TGK和TP有显着性影响(P<0.05),且对血清生化指标ALP、AST、ALT、TGK和TP有极显着影响(P<0.01),血清TCHO、MDA呈下降趋势,但未达到显着水平(P>0.05),CAT呈上升趋势,但未达到显着水平(P>0.05)。由此得知,在豆粕替代45%鱼粉蛋白饲料中添加一定浓度的灭活乳酸杆菌P-8对大菱鲆幼鱼血清生化指标和抗氧化能力有显着性影响。
关键词:灭活植物乳酸杆菌P-8;大菱鲆;豆粕;抗氧化能力;血清生化指标
大菱鲆是原产于欧洲的一种天然良种,因其对生态环境的超强适应能力、快速的生长速度以及优良的品质,成为各国竞相引种的对象。自从20世纪末我国水产科学家雷霁霖院士从英国引进以来,大菱鲆产业迅速发展并产生巨大的经济和社会效益,中国目前已经成为世界大菱鲆人工养殖大国。然而近些年来随着人们对水产动物需求量的不断攀升,鱼粉却出现产量下降价格飙升,鱼粉短缺已成为一个全球性问题。因此水产饲料中植物饲料的使用受到高度的关注。豆粕由于其蛋白含量高、氨基酸相对平衡、价格合理[1]而成为重要的鱼粉替代蛋白源。但是,豆粕中的胰蛋白酶抑制因子和血球凝集素等抗营养因子以及氨基酸的不平衡性和可利用性限制其在鱼类饲料中的用量。研究表明,全脂大豆或浸提豆粕会抑制生长,降低饲料效率[2]。豆粕中的抗营养因子会损伤肠道[3],影响肠道内的微生态环境[4],抑制消化酶的活性[5],影响营养物质的消化吸收。某些含抗营养素的植物源饲料原料可引发急性中毒症状;但在正常饲喂条件下,通常只有长期摄食某种特定植物才会产生轻微的负面效应。这类效应包括干扰消化过程及生长、降低饲料效率、胰腺肥大症、低血糖、肝功能障碍、异性生殖和免疫抑制。能否在低鱼粉含量条件下寻找到一种促进生长的安全有效的添加剂显得尤为重要。
最近饲料添加剂越来越多地用作鱼类免疫刺激剂[6],在这些添加剂里使用最广泛和效果最显着的就是益生菌。对益生菌的定义包括活的或者死的微生物细胞代谢产物,能够调节动物肠道菌群和刺激免疫酶活,不一定是活菌,只要能对宿主产生益生作用[7]。有益生功能的细菌无论是以活菌形式添加[8-9]还是以灭活菌的形式添加[10-14]都显示出积极的促健康性能。加热灭活的植物乳酸杆菌(HK-LP)赋予了乳酸菌新的性能。乳酸菌是不耐高温高压的,但是HK-LP能够抵抗饲料制粒过程中的高温高压,最近五年内这种新性能在农场动物饲料中得到广泛应用[15-16]。由于口服活的益生菌可能会将活的细菌引进到开放水环境中,又引发人们对水产业新的担忧。在这种担忧下,灭活菌因为不会与其他的水生生物相互作用而不存在安全隐患,替代活菌制剂在水产养殖上崭露头角[12]。灭活菌和活菌在免疫反应方面的许多对比研究结果显示加热灭活的酪酸菌在鮸鱼身上有明显的免疫调节性能[17];加热灭活的创伤弧菌疫苗比福尔马林灭活的疫苗在牙鲆身上能更好地引起免疫应答[18];加热灭活的小肠结肠炎耶尔森氏菌能够保持小鼠免疫调节性能[19]。HK-LP用作小白鼠免疫刺激剂诱导小鼠产生白介素12和抗癌抗菌素,增加伽马干扰素的生成,进而抑制病毒繁殖和其他的T细胞并活化启动巨噬细胞吞噬作用[20];日粮中添加HK-LP能够提高健康成年人[21]和肉鸡[16]的免疫力。
肉食性鱼类不适应消化含高植物蛋白的饲料,其饲料中添加豆粕易引发其肠道炎症。肠粘膜作为鱼类免疫系统的第一道非特异性免疫屏障,受到损害后,致病菌会侵入机体。普遍认为肠道有益菌群和肠道上皮细胞间的相互作用在动物肠道粘膜免疫方面起了重要作用。乳酸菌通过生物拮抗作用改善试验动物肠道微生态环境,增强肠道上皮细胞的屏障层,调节肠道菌群平衡,抑制有害菌的感染和肠内腐败。本试验希望通过灭活植物乳酸杆菌的益生功能削弱豆粕带来的消极作用,调节大菱鲆肠道健康,改善其营养状况,促进大菱鲆幼鱼生长,提高大菱鲆幼鱼的免疫力,从而提高大菱鲆对豆粕这种植物蛋白源的耐受力,提高植物蛋白在肉食性鱼类饲料中的替代比。
1材料和方法
1.1饲料制作
植物乳酸菌菌种由内蒙古农业大学食品科学与工程实验室提供,菌种以冻干形式保存的,MRS肉汤培养基37 ℃培养24 h活化,80%甘油保存在-80 ℃冰箱中作为菌种保存备用。MRS琼脂培养基划线培养48 h,挑取单菌落,接种于MRS肉汤培养基24 h,16 500 g离心10 min,PBS洗涤三次重悬,MRS琼脂培养基培养48~36 h计数。
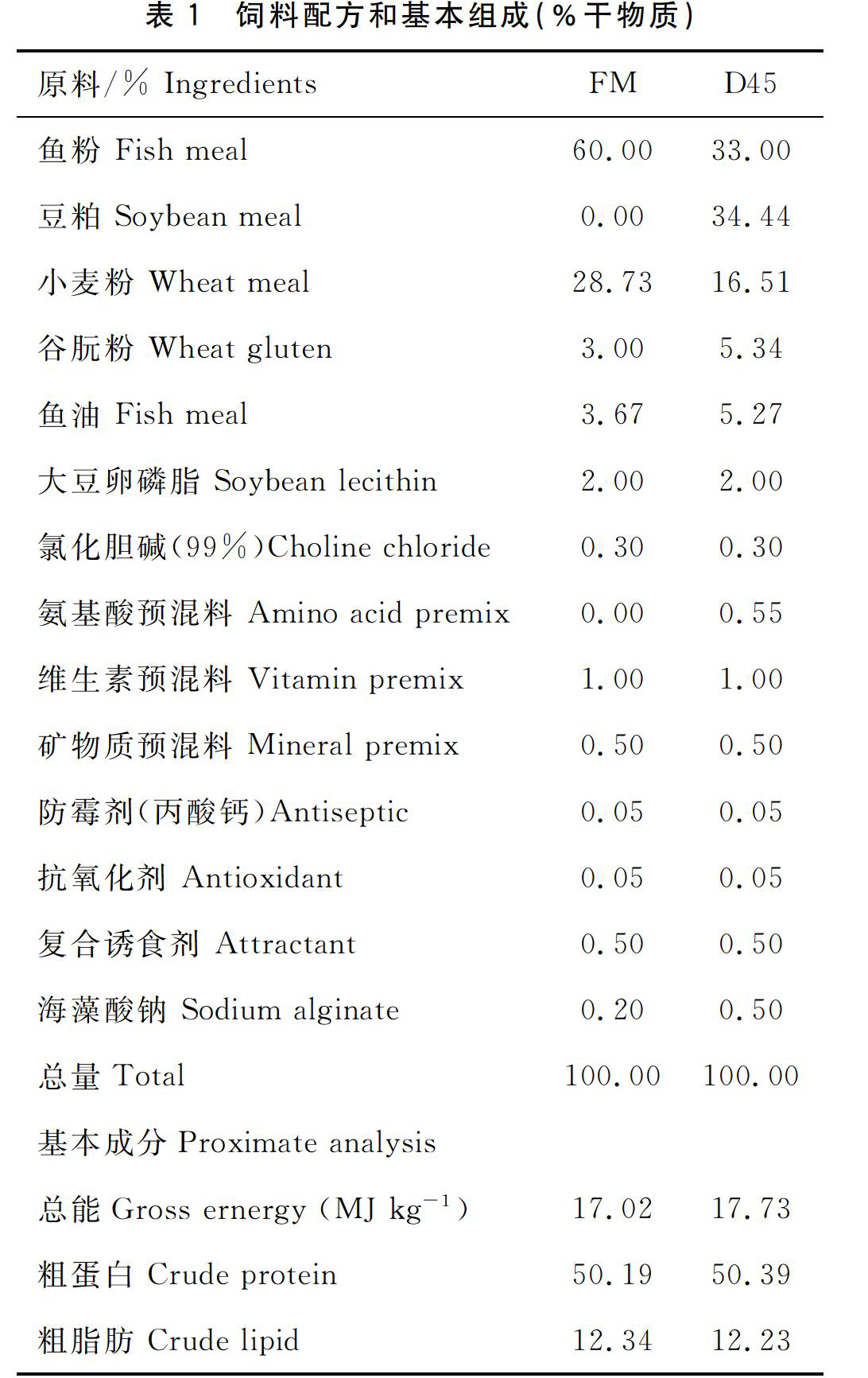
分别以鱼粉(粗蛋白71.58,粗脂肪9.6)和豆粕(粗蛋白55.60,粗脂肪 2.0)为主要蛋白源,小麦粉作为糖源,配置两种基础饲料(FM,SM),基础配方见表1。在两种基础饲料中添加加热灭活菌,添加剂量为107CFU/g和109CFU/g,配制出6种等氮等能的试验饲料,依次分别对应命名为FM组:S0A0,S0A7,S0A9;SM组:S45A0,S45A7,S45A9。在饲料制作过程中,所有原料粉碎后过320μm筛网,各原料按配比定量后混合均匀,然后加入适量的水揉匀,经F(Ⅱ)-26型双螺杆挤条机(华南理工大学,广州)加工制成硬颗粒饲料(1.5 mm×2.0 mm,2.5 mm×3.0 mm),105 ℃烘干至饲料水分含量为10%左右,用塑料袋包装,保存于-20 ℃冰柜中备用。从不同区域随机取几粒饲料,PBS溶解离心取上清,MRS琼脂培养基划线培养3 d,无菌落长出。
1.2实验鱼的来源、驯化与养殖管理
试验在青岛即墨七好生物科技有限公司进行。大菱鲆鱼苗从当地一家育苗场繁育的同一批鱼苗。在开始正式实验前,幼鱼放于循环水养殖系统中暂养2周,并以基础饲料FM饱食投喂,使之逐渐适应实验饲料和养殖环境。实验开始时,实验鱼饥饿24 h,然后称质量,并挑选出规格一致(平均初始体质量为(7.82± 0.68)g的大菱鲆进行分组实验。实验在18个循环水养殖系统中进行,放养密度为30条/桶。每一桶为一组,每种饲料随机投喂3组实验鱼。每天饱食投喂2次(7:00和18:00)。养殖周期 10周。每天记录投饲量,如有死鱼记录数量并称重。实验期间海温度为18~20 ℃,盐度24‰~26‰,溶氧保持>7 mg/L。
1.3样品收集
70 d生长实验结束后,对实验鱼饥饿24 h,分别从每桶抽取5条鱼,以1 mL无菌注射器从尾静脉取血,室温自然沉降2 h,然后4 ℃沉降4~6 h,分离血清并保存在-80 ℃冰箱,以备使用。
血清生化指标:血清送至湖北武汉长江水产研究所检测,检测指标包括谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、总胆固醇(TCHO)、总蛋白(TP)、甘油三酯(TGK)。
免疫指标:血清超氧化物歧化酶( superoxide dismutase,SOD )、丙二醛( malonaldehyde,MDA) 浓度、过氧化氢酶(catalase,CAT)采用相关的专用试剂盒测定( 南京建成生物工程研究所,南京)。
1.4统计分析
实验结果利用双因素方差分析(two-way ANOVA),若两个因素之间存在交互作用,则利用单因素方差分析考察所有处理组之间的差异,若差异显着,再进行Turkeys 多重比较。如果HK-LP浓度对结果有显着性影响,则利用单因素方差分析和Turkeys多重比较考察各浓度处理组各项指标之间的差异;当P<0.05时认为存在显着性差异。所有数据都采用SPSS17.0软件进行处理 。
5、诱食剂 (mg kg-1饲料): 甜菜碱, 2; 硫代甜菜碱, 1; 苏氨酸, 1; 丙氨酸 0.5; 5′-磷酸肌苷, 0.5.
2结果
2.1血清生化指标
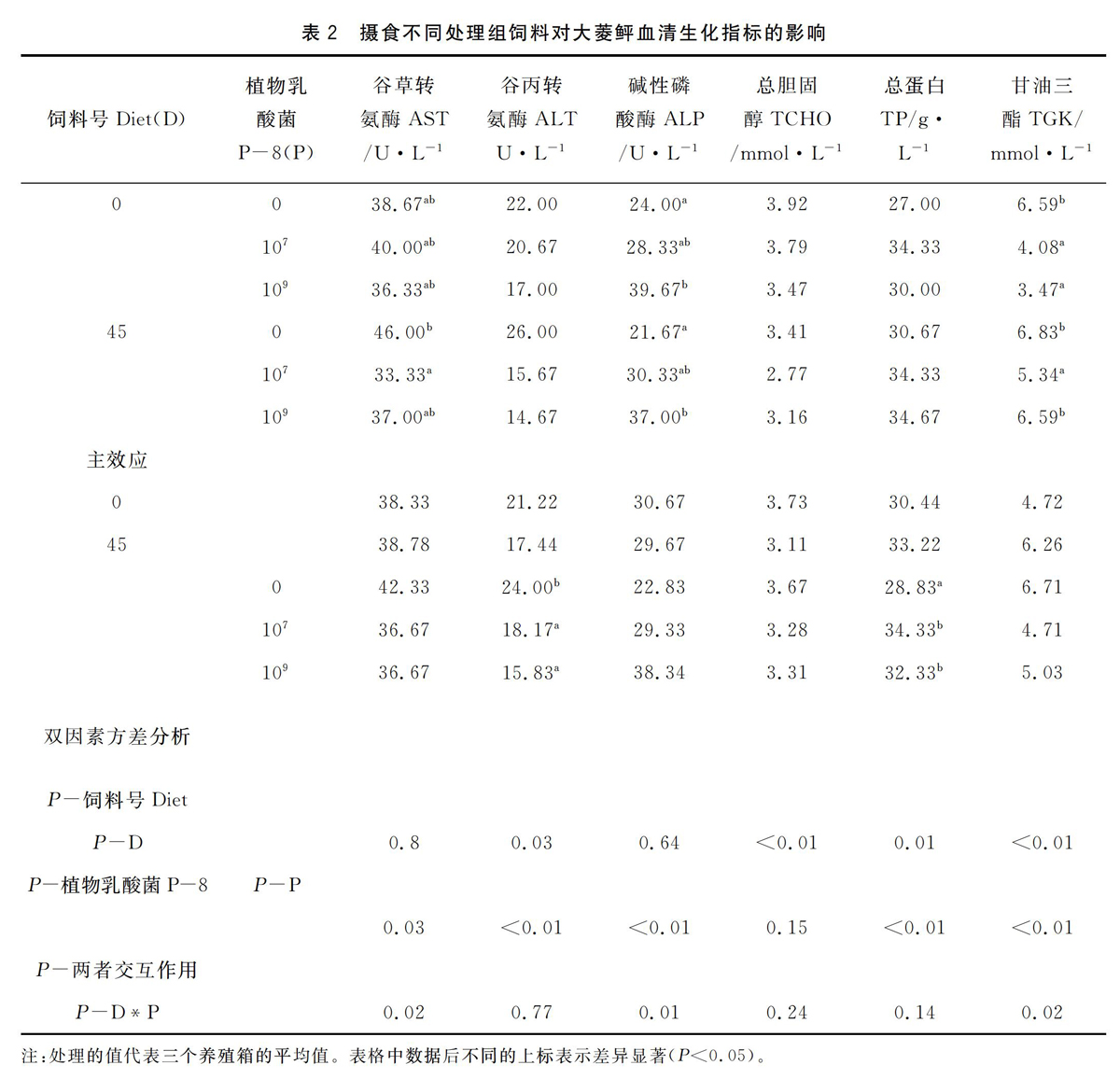
D、P两因素在血清指标ALT、TP、TCHO没有交互作用。HK-LP占主要作用,在不考虑基础饲料因素时,随着HK-LP添加浓度的增加,ALT活性显着降低。添加豆粕后TCHO显着降低;同全鱼粉组,TCHO 随HK-LP浓度增加呈下降趋势,但是作用不显着(P>0.05)。总蛋白含量随着HK-LP添加浓度增加而显着增加(P<0.05)。在血清AST、ALP、TGK指标方面,D、P两因素有交互作用(P<0.05)。豆粕45%替代组,随着HK-LP浓度增加,AST活性显着降低;全鱼粉组,HK-LP三个处理间无显着差异。S45R0组血清AST显着高于S0R0(P<0.05),但添加HK-LP后S45R7和S45R9与对照组S0R0无显着差异(P>0.05),即添加HK-LP使豆粕替代组的AST活力从显着高于对照组变为与对照组无显着差异。在同一饲料号组,ALP活力随HK-LP浓度增加而显着升高(P<005);同一HK-LP添加浓度下,全鱼粉和豆粕无显着性差异(P>0.05)。当HK-LP添加107时,全鱼粉组和豆粕组的大菱鲆甘油三酯含量都显着低于不添加组;同一饲料组,大菱鲆甘油三酯水平随HK-LP添加浓度增加而显着降低(P<0.05)(见表2)。
2.2血清抗氧化力
双因素结果分析显示SOD极显着地受到D和P两个因素的影响(P<0.05),D和P两因素对SOD的影响有交互作用(P<0.05)。在不添加HK-LP时,豆粕饲料SOD活性显着低于鱼粉饲料。添加HK-LP后,SOD活性显着升高。在豆粕替代45%鱼粉组,SOD活性随HK-LP添加剂量的增加而显着升高,而在全鱼粉组三个浓度处理间无显着性差异。S45R0这一处理SOD活力极显着低于FM组,而添加HK-LP后,S45R7活性高于S0R0,说明含豆粕饲料添加HK-LP后SOD可以达到全鱼粉的水平。CAT和MDA有着相反的变化趋势,但是D、P两因素没有交互作用(P>0.05)。在对MDA影响上,饲料占主要因素,在不考虑P因素时,含豆粕饲料显着提高了MDA含量(P<0.05);在同一饲料组,MDA在HK-LP三个处理间没有显着性差异。CAT活力值在14.06~21.95之间,各处理组间均没有显着性差异(P>0.05,见表3)。表3摄食各处理组饲料大菱鲆的免疫酶活性的影响
饲料号
3讨论
血清指标是反应鱼类在遭遇营养和环境状况改变时生理应激反应和综合健康状况的重要指标[22]。谷草转氨酶(AST)和谷丙转氨酶(ALT)是广泛存在于动物线粒体中的重要氨基酸转移酶,在机体蛋白质代谢中起着重要的作用[23]。通常作为衡量肝脏功能的指标,其分泌到血液里含量的多少取决于肝脏细胞受损伤的程度[24]。机体在正常状态下AST和ALT存在细胞内部,由于细胞膜的屏蔽作用不容易逸出,血液中AST和ALT活性极低,但鱼体肝脏受到损伤后扩散于血液中,血液中AST和ALT活性会升高。豆粕替代45%鱼粉蛋白时AST和ALT都升高,但是当大菱鲆饲喂含HK-LP饲料后,AST和ALT活性均有不同程度的降低,尤其是喂食含豆粕饲料组,添加HK-LP与不添加HK-LP相比,AST有显着性降低,表明乳酸菌能够在一定程度上对肝脏起到保护作用,这与朱学芝等[25](2007)在凡纳滨对虾上取得的结果一致。血清中胆固醇和甘油三酯含量的变化情况是反映机体脂质代谢功能正常与否的主要指标。含豆粕饲料组大菱鲆血清的胆固醇与全鱼粉组相比降低。当植物蛋白源替代饲料中鱼粉后,虹鳟[26]和舌齿鲈(Dicentrarchuslabrax)[27]血浆中的胆固醇也呈现降低的趋势。研究表明,植物产物会降低陆生动物体内的胆固醇含量,主要是由植物产物中的类雌激素异黄酮所致[28]。陈京华[29](2006)报道,使用豆粕替代鱼粉蛋白后在替代的基础上添加不同梯度的胆固醇饲喂牙鲆,结果表明豆粕替代鱼粉后导致生长和血浆胆固醇浓度显着下降,但补充1%的胆固醇显着提高其生长和血浆胆固醇浓度,且与鱼粉组无显着差异。HK-LP组血清中甘油三酯减少,Mahmoud[30]也得出相似结论,认为鱼类饲料添加某一浓度的HK-LP会保持鱼类血清低浓度胆固醇和甘油三酯含量。外源乳酸菌可能是通过调控机体的3-羟基-3-甲基戊二酰辅酶A(HMG-Co A)还原酶及胆固醇7α-水解酶(CYP7A1)的合成和表达、降低胆固醇的重吸收等方式来降低机体胆固醇含量的[31],也有体外试验结果表明乳酸菌菌体细胞通过吸收、共沉淀、酶解转化等途径降低介质中胆固醇的含量,具体机制需要进一步验证[32]。血清总蛋白(TP)是反映肝脏合成蛋白质能力的重要指标,该指标下降通常表明动物机体处于应激状态[33]。虹鳟饲喂益生菌饲料试验中也得到类似结论[13-14]。酸性磷酸酶(ACP)和碱性磷酸酶(ALP)通常作为刺参免疫指标,Yang 等[34](2015)在海参上的研究,当加热灭活的植物乳酸菌L-137在饲料中添加005 g时,体液中ACP和AKP活性显着提升。ALP参与消化外来蛋白、脂肪和糖类。Cheng[35](1989)指出酸性磷酸酶是一种典型的溶酶体酶,在免疫反应中能够杀死和消化病原微生物,而碱性磷酸酶是一种多功能的酶,水解磷酸单酯基底,在碱性环境中担当磷酸变位酶[36]。Xing等[37](2002)研究栉孔扇贝试验中ALP活力高的试验处理组,免疫也强大。本试验含豆粕饲料没有对ALP产生显着性影响,但是在添加HK-LP后,ALP活性产生显着性升高,表明HK-LP提高了大菱鲆免疫能力。Panigrahi等[13]( 2010)指出血脂成分是重要的能源储备,受到益生菌添加量的影响。
在正常情况下,动物机体内会不断产生自由基和内源性抗自由基的活性物质,自由基的生成与机体抗氧化防御系统之间处于一种良好的动态平衡中。鱼类抗氧化指标与鱼体免疫系统息息相关。SOD和CAT是生物机体内重要的抗氧化酶,发挥着活性氧化剂清除剂的作用,在清除超氧自由基、过氧化氢和过氧化物以及阻止或减少羟基自由基形成等方面发挥重要作用。MDA是氧自由基攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成的脂质过氧化物,其高低可以间接反应机体细胞受自由基攻击的严重程度。在本研究中,含豆粕的饲料饲喂大菱鲆后,SOD活性降低相对的MDA含量升高,说明豆粕替代45%鱼粉蛋白会降低鱼类抗氧化能力。类似地,杨严鸥等[38](2006)研究发现豆粕替代鱼粉蛋白,黄颡鱼SOD和溶菌酶活力显着性降低,即免疫力显着降低, 而且豆粕添加量越大,免疫力就越低。张锦绣等[39](2003)也发现豆粕能使建鲤的肠道发生病变,使建鲤的免疫力下降。这可能也是由于饲料豆粕中的抗营养因子及氨基酸的不平衡等因素, 降低了鱼类对饲料的消化、吸收, 而鱼体在得不到良好的营养条件时免疫力会下降。本研究在饲料中添加合适浓度HK-LP后,发现含豆粕饲料组抗氧化指标能够达到全鱼粉水平,无显着性差异,说明HK-LP作为免疫刺激剂,提高了大菱鲆幼鱼的抗氧化能力。灭活菌的益生作用已经在很多试验中得到证实。Salinas等[40](2008)研究指出加热灭活的德式乳酸杆菌和枯草芽孢杆菌可以提高金头鲷的补体活性、血清过氧化物酶活性和吞噬作用。相似,Irianto和Austin[41](2002)也表示灭活菌可以刺激虹鳟的非特异性免疫。本研究结果表明HK-LP可以通过提高大菱鲆幼鱼的免疫力,从而提高其对豆粕蛋白的耐受力。灭活菌的免疫调节能力可能是由于某一微生物成分的存在,比如多糖荚膜、肽聚糖和磷脂壁酸,都能够有效地刺激免疫系统。益生菌或者某一组成部分刺激鱼类免疫系统的机制还不是很明确。Dawood等[30](2015)在真鲷饲料中添加加热灭活的植物乳酸杆菌和β-葡聚糖,确定了两因素在真鲷生长、消化和非特异性免疫方面有交互作用。很多学者研究过益生菌和益生元之间的协同作用。加热灭活的粪肠球菌和甘露寡糖配合使用增加了鱼类体表粘液分泌量,抵御环境污染和应激源[12]。益生元本质是一种不能被动物肠道自然消化的碳水化合物,通常与益生菌一起使用,通过调节肠道微生态和刺激免疫系统来促进生物长期健康生长。
目前尚没有明确将灭活细菌归于益生菌、免疫增强剂抑或口服疫苗的某一类别。然而使用灭活的细菌作为饲料添加剂对水产养殖的益处亟待深入研究。
4结论
综合分析,豆粕替代45%鱼粉蛋白会降低大菱鲆幼鱼的抗氧化能力,损害大菱鲆幼鱼的肝脏,但是添加HK-LP能在一定程度上改善大菱鲆幼鱼的免疫力,降低谷草转氨酶和谷丙转氨酶活性,对肝脏有一定保护作用,从而提高大菱鲆对豆粕蛋白的耐受力。
参考文献:
[1] Hardy R W.Utilization of plant proteins in fish diets:effects of global demand and supplies of fishmeal[J].Aquaculture Research,2010,41(5):770-776
[2] Refstie S, Storebakken T, Roem A J. Feed consumption and conversion in Atlantic salmon (Salmo salar) fed diets with fish meal, extracted soybean meal or soybean meal with reduced content of oligosaccharides, trypsin inhibitors, lectins and soya antigens[J]. Aquaculture, 1998,162(3): 301-312
[3] Baeverfjord G, Krogdahl . Development and regression of soybean meal induced enteritis in Atlantic salmon, Salmo salar L., distal intestine: a comparison with the intestines of fasted fish[J]. Journal of Fish Diseases, 1996,19(5): 375-387
[4]Ring E, Sperstad S, Myklebust R, et al. Characterisation of the microbiota associated with intestine of Atlantic cod (Gadus morhua L.): the effect of fish meal, standard soybean meal and a bioprocessed soybean meal[J]. Aquaculture, 2006,261(3): 829-841
[5] Krogdahl , Bakke‐McKellep A M, Baeverfjord G. Effects of graded levels of standard soybean meal on intestinal structure, mucosal enzyme activities, and pancreatic response in Atlantic salmon (Salmo salar L.)[J]. Aquaculture Nutrition, 2003,9(6): 361-371
[6] Merrifield D L,Dimitroglou A,Foey A,et al.The current status and future focus of probiotic and prebiotic applications for salmonids[J].Aquaculture,2010,302(1):1-18
[7] Sal minen S,Ouwehand A,Benno Y,et al.Probiotics:how should they be defined?[J].Trends in food science & technology,1999,10(3):107-110
[8] Butprom S,Phumkhachorn P,Rattanachaikunsopon P.Effect of Lactobacillus plantarum C014 on innate immune response and disease resistance against Aeromonas hydrophila in hybrid catfish[J].The Scientific World Journal,2013,2013
[9] Giri S S,Sukumaran V,Sen S S,et al.Effects of dietary supplementation of potential probiotic Bacillus subtilis VSG1 singularly or in combination with Lactobacillus plantarum VSG3 or/and Pseudomonas aeruginosa VSG2 on the growth,immunity and disease resistance of Labeo rohita[J].Aquaculture Nutrition,2014,20(2):163-171
[10] Biswas G,Korenaga H,Naga mine R,et al.Cytokine responses in the Japanese pufferfish (Takifugu rubripes) head kidney cells induced with heat-killed probiotics isolated from the Mongolian dairy products[J].Fish & shellfish immunology,2013,34(5):1170-1177
[11] Choi S H,Yoon T J.Non-specific immune response of rainbow trout (Oncorhynchus Mykiss) by dietary heat-inactivated potential probiotics[J].Immune Network,2008,8(3):67-74
[12] Díaz-Rosales P,Salinas I,Rodríguez A,et al.Gilthead seabream (Sparus aurata L.) innate immune response after dietary ad ministration of heat-inactivated potential probiotics[J].Fish & shellfish immunology,2006,20(4):482-492
[13] Panigrahi A,Kiron V,Puangkaew J,et al.The viability of probiotic bacteria as a factor influencing the immune response in rainbow trout Oncorhynchus mykiss[J].Aquaculture,2005,243(1):241-254
[14] Rodriguez-Estrada U,Satoh S,Haga Y,et al.Effects of inactivated Enterococcus faecalis and mannan oligosaccharide and their combination on growth,immunity,and disease protection in rainbow trout[J].North American Journal of Aquaculture,2013,75(3):416-428
[15] Tung H T,Koshio S,Teshima S,et al.Effects of heat-killed Lactobacillus plantarum supplemental diets on growth performance,stress resistance and immune response of juvenile Kuruma shrimp Marsupenaeus japonicus bate[J].Aquaculture Science (Japan),2009
[16] Khonyoung D,Yamauchi K.Effects of heat-killed Lactobacillus plantarum L-137 on morphology of intestinal villi and epithelial cells in broiler chickens[J].Journal of Applied Animal Research,2012,40(2):140-147
[17] Pan X,Wu T,Song Z,et al.Immune responses and enhanced disease resistance in Chinese drum,Miichthys miiuy (Basilewsky),after oral ad ministration of live or dead cells of Clostridium butyrium CB2[J].Journal of fish diseases,2008,31(9):679-686
[18] Park J H,Park W J,Do Jeong H.Immunological efficacy of Vibrio vulnificus bacterins given as an oral vaccine in the flounder,Paralichthys olivaceus[J].Aquaculture,2001,201(3):187-197
[19] Ruiz‐Bravo A,Bujalance C,Romero F,et al.Immunomodulation by Yersinia enterocolitica:comparison of live and heat‐killed bacteria[J].FEMS Immunology & Medical Microbiology,2003,39(3):229-233
[20] Murosaki S,Muroyama K,Yamamoto Y,et al.Antitumor effect of heat-killed Lactobacillus plantarum L-137 through restoration of impaired interleukin-12 production in tumor-bearing mice[J].Cancer Immunology,Immunotherapy,2000,49(3):157-164
[21] Hirose Y,Murosaki S,Yamamoto Y,et al.Daily intake of heat-killed Lactobacillus plantarum L-137 augments acquired immunity in healthy adults[J].The Journal of nutrition,2006,136(12):3069-3073
[22] Kader M A,Bulbul M,Koshio S,et al.Effect of complete replacement of fishmeal by dehulled soybean meal with crude attractants supplementation in diets for red sea bream,Pagrus major[J].Aquaculture,2012,350:109-116
[23] Lin L,Zeng X L,Zhang J.Effect of profenofos poisoning on liver lipid peroxidation and liver function in rabbits[J].Chinese Journal of Clinic Rehabilitation,2004,8(21):4380-4381
[24] Lemaire P,Drai P,Mathieu A,et al.Changes with different diets in plasma enzymes (GOT,GPT,LDH,ALP) and plasma lipids (cholesterol,triglycerides) of sea-bass (Dicentrarchus labrax)[J].Aquaculture,1991,93(1):63-75
[25] 朱学芝,郑石轩,潘庆军,等.芽孢杆菌对凡纳滨对虾免疫和生化指标的影响[J].饲料研究,2007(4):56-59
[26] Kaushik S J, Cravedi J P, Lalles J P, et al. Partial or total replacement of fish meal by soybean protein on growth, protein utilization, potential estrogenic or antigenic effects, cholesterolemia and flesh quality in rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 1995, 133(3): 257-274
[27] Kaushik S J, Coves D, Dutto G, et al. Almost total replacement of fish meal by plant protein sources in the diet of a marine teleost, the European seabass, Dicentrarchus labrax[J]. Aquaculture, 2004, 230(1): 391-404
[28] Setchell K D R, Cassidy A. Dietary isoflavones: biological effects and relevance to human health[J]. The journal of nutrition, 1999, 129(3): 758S-767S
[29] 陈京华. 微生物发酵, 外源酶制剂和促摄食物质对牙鲆 (Paralichthysolivaceus) 利用豆粕蛋白的影响[D]. 青岛:中国海洋大学,2006
[30] Dawood M A O, Koshio S, Ishikawa M, et al. Interaction effects of dietary supplementation of heat-killed Lactobacillus plantarum and β-glucan on growth performance, digestibility and immune response of juvenile red sea bream, Pagrus major[J]. Fish & shellfish immunology, 2015, 45(1): 33-42
[31] 王文梅,许丽.乳酸菌体外和体内降解胆固醇的机理及其应用[J].动物营养学报,2014,26(2):295-303
[32] 宋明鑫,许丽,王文梅,等.乳酸菌降解胆固醇的作用机理及其在动物中的研究现状[J].饲料工业,2011,32(22):48-51
[33] Stangl R,Szijártó A,?nody P,et al.Reduction of liver ischemia-reperfusion injury via gluta mine pretreatment[J].Journal of Surgical Research,2011,166(1):95-103
[34] Yang H,Han Y,Ren T,et al.Effects of dietary heat‐killed Lactobacillus plantarum L‐137 (HK L‐137) on the growth performance,digestive enzymes and selected non‐specific immune responses in sea cucumber,Apostichopus japonicus Selenka[J].Aquaculture Research,2015
[35] Cheng T C.Immunodeficiency diseases in marine mollusks:measurements of some variables[J].Journal of Aquatic Animal Health,1989,1(3):209-216
[36] Blasco J,Puppo J,Sarasquete M C.Acid and alkaline phosphatase activities in the clam Ruditapes philippinarum[J].Marine Biology,1993,115(1):113-118
[37] Xing J,Zhan W B,Zhou L.Endoenzymes associated with haemocyte types in the scallop (Chlamys farreri)[J].Fish & shellfish immunology,2002,13(4):271-278



